지놈앤컴퍼니, 바벤시오·GEN-001 병용 요법 결과 발표…3차 치료제
GEN-001, 기술 이전 위해 개발…키트루타 병용 담도암 2상도 진행중
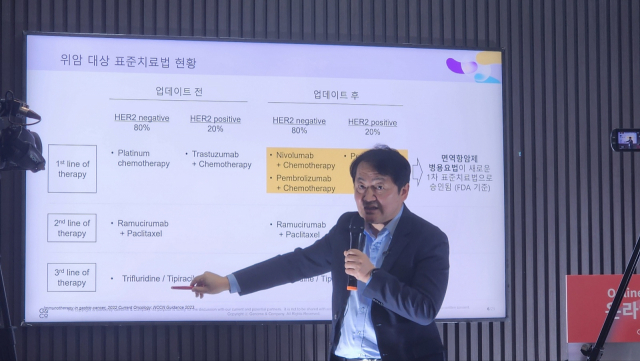
배지수 지놈앤컴퍼니 대표가 19일 기자간담회에서 마이크로바이옴 면역항암제 ‘GEN-001’의 위암 대상 임상 2상 결과를 발표하고 있다. <사진=조희연 기자>
지놈앤컴퍼니가 마이크로바이옴 면역항암제의 임상 2상 결과를 발표했다. 위암 3차 치료 환자를 대상으로 한 임상에서 면역항암제와 마이크로바이옴 치료제 병용 요법이 시너지 효과가 있는 것으로 확인됐다.
19일 지놈앤컴퍼니는 기자간담회를 열고 마이크로바이옴 면역항암치료제 ‘GEN-001’의 국내 임상 2상 컷오프 데이터에 대해 설명했다. 이번 임상 2상 연구결과는 지난 18일(미국 현지시간) 미국 임상종양학회 소화기암 심포지엄(ASCO GI)에서 포스터 발표됐다.
GEN-001은 락토코커스 락티스 단일균주를 주성분으로 하는 경구용 마이크로바이옴 치료제다. 위암 대상 임상 2상은 독일 머크의 바벤시오(성분명 아벨루맙)와 병용투여로 진행했다.
이번 임상은 이전 면역 항암제 투여와 관계없이 2차 이상의 표준치료에 실패한 PD-L1 양성진행성위암 또는 위식도 접합부 선종암 환자 42명을 대상으로 국내 6개 기관에서 시행 중이다.
지놈앤컴퍼니는 3차 치료제 시장에 먼저 뛰어든 후 순차적으로 영역을 넓혀갈 계획이다. 암 치료시 1차 치료제가 효과가 없을 경우 2차, 3차 치료제 순으로 약물을 변경한다.
이번 임상 2상에 참여한 42명 환자대상 유효성 평가 결과 부분반응(PR)은 7건으로나타났다. 특히, 기존 면역항암제 투여를 받은 적이 있으며 이에 불응한환자 8명 가운데 3명(객관적반응률, 37.5%)에서 부분반응을 보였다.
카플란마이어분석을 통해 추정되는 무진행생존기간(PFS)의 중간값은 1.7개월, 전체생존율(OS)의 중간값은 7.9개월로 나타났다.
특히, 지놈앤컴퍼니는 1차 치료시 면역항암제를 투여했지만 효과를 보지못했거나 혹은 다시 재발했을 경우를 고려해 임상 2상 환자를 모집하며 기존에 면역항암제 투여 경험이 있는 환자들을 모으기 위해 노력했다.
배지수 지놈앤컴퍼니 대표는 이날 “위암 3차 치료에서 바벤시오(아벨루맙) 단독으로는 객관적반응률 2.2%, 전체생존기간 4.6개월을 보였지만 GEN-001과 병용 시에는 객관적반응률 16.7%, 전체생존기간 7.9개월을 보였다”고 말했다.
배 대표는 “특히 기존에 면역항암제를 투여받았던 환자 8명 중 3명에서 종양이 줄어 37.5%라는 높은 반응률을 확인했다”면서 “이 8명 환자의 무진행 생존 기간은 5.67개월이 나왔고, 전체 생존기간의 경우 아직 생존자가 많아 데이터를 도출하지 못했으나 훨씬 더 오래 사실거라는 긍정적인 기대를 하고 있다”고 말했다.
이어 배 대표는 “면역항암제와 서로 다른 면역항암제 2개를 적용했을 경우 면역 이상 반응이 생기는 경우가 종종 있어 걱정했으나 마이크로바이옴의 경우 큰 문제가 없었다”면서 “마이크로바이옴이 면역항암제의 병용 파트너로 유효성도 좋지만 부작용이 거의 없어 안전하고 이상적인 파트너임을 보여준다”고 설명했다.
현재 지놈앤컴퍼니는 기술이전을 목표로 ‘GEN-001’을 개발하고 있다. 배지수 대표는 “현재 머크 측에서 이번 임상에 대해 상당히 큰 관심을 보이고 있다”면서 “면역항암제 ‘키트루다’와의 병용 담도암 임상 2상을 진행하고 있어, 그 결과에 따라 파이프라인의 매력도를 더욱 높일 수 있을 것”이라고 기대했다.
[CEO스코어데일리 / 조희연 기자 / chy@ceoscore.co.kr]



![[중견차 3사3색 돌파구] ③KG모빌리티, 전방위 체질개선 돌입…신시장 개척 박차](https://www.ceoscoredaily.com/photos/2024/05/02/2024050216511838910_m.jpg)
![[중견차 3사3색 돌파구] ②르노코리아, ‘르노 DNA’로 새출발…신차 공세 ‘시동’](https://www.ceoscoredaily.com/photos/2024/04/30/2024043016323768783_m.jpg)
![[중견차 3사3색 돌파구] ①한국GM, 쉐보레·캐딜락·GMC ‘멀티 브랜드 전략’ 가속](https://www.ceoscoredaily.com/photos/2024/04/29/2024042917410481170_m.jpg)

![[그래픽] 신한금융 디지털 재무적 기여도](https://www.ceoscoredaily.com/photos/2024/05/02/2024050210000591039_m.jpg)
























































































![[24-03호]_500대기업 R&D 투자 현황](https://www.ceoscoredaily.com/photos/2024/04/17/2024041718513086340_m.jpg)

![[이달의 주식부호] 홍라희 여사 2위 탈환…곽동신 한미반도체 부회장 6위로 2계단↑](https://www.ceoscoredaily.com/photos/2024/04/03/2024040314314813956_m.jpg)



![[그래픽] 그레이트 컴퍼니 우수기업 리스트](https://www.ceoscoredaily.com/photos/2023/08/24/2023082410452781615_m.jpg)



댓글
[ 300자 이내 / 현재: 0자 ]
현재 총 0개의 댓글이 있습니다.