
서울시 동대문구 동아에스티 본사 전경. <사진제공=동아에스티>
동아에스티(사장 김민영)의 자회사 뉴로보 파마슈티컬스는 ‘MASH(대사이상 관련 지방간염) 치료제 ‘DA-1241’의 글로벌 임상 2상 파트2 를 개시했다고 19일 밝혔다.
뉴로보 파마슈티컬스는 지난해 5월 미국 식품의약국(FDA)으로부터 DA-1241의 글로벌 임상 2상 파트1을 승인받고, 지난해 9월 첫 환자 투약을 개시했다. 파트1에서는 DA-1241의 단독 효능과 안전성을 확인할 예정이다.
이번 임상 2상 파트2는 DA-1241과 시타글립틴 병용 투여의 효능과 안전성을 확인하기 위해 MASH 환자 37명을 대상으로 16주간 다기관, 무작위 배정, 이중 눈가림, 위약 대조, 평행 비교 방식으로 진행된다.
뉴로보 파마슈티컬스는 MASH를 다각도로 치료할 수 있는 치료제를 개발하기위해 DA-1241과 다양한 약물의 병용 투여 전임상을 진행해 왔다.
DA-1241과 시타글립틴 병용 투여 전임상에서 독성이 없음을 확인하며 안전성을 입증했으며, DA-1241 단독 투여시 보다 항염증 효과가 증가됨을 확인했다.
DA-1241은 GPR119 agonist(작용제) 기전의 계열내최초(First-in-Class) 신약으로 전임상에서 MASH 치료제 개발 가능성이 확인됐다. DA-1241 투여 후 간경화, 염증, 섬유화, 지질 대사 및 포도당 조절 등의 개선 효과를 확인했다.
뉴로보 파마슈티컬스는DA-1241 글로벌 임상 2상 파트1, 파트2를2024년 하반기에 종료할 계획이다.
뉴로보 파마슈티컬스는 미국 보스턴에 위치한 나스닥 상장사로, DA-1241과DA-1726의 글로벌 개발 및 상업화를 담당하는 동아쏘시오그룹의 글로벌 R&D 전진기지다.
GLP1R/GCGR dual agonist로서 비만과MASH 치료제로 개발 중인 DA-1726은 지난해12월 글로벌 임상 1상 IND를 신청했다.
김형헌 뉴로보 파마슈티컬스 대표는 “DA-1241과 시타글립틴의 병용 투여 전임상에서 효과적이고 안전한MASH 치료제의 가능성을 확인했다”며 “DA-1241 글로벌 임상2상을 순조롭게 진행해2024년 하반기 성공적인 임상 데이터를 도출해 내겠다”고 말했다.
[CEO스코어데일리 / 조희연 기자 / chy@ceoscore.co.kr]



![[중견차 3사3색 돌파구] ②르노코리아, ‘르노 DNA’로 새출발…신차 공세 ‘시동’](https://www.ceoscoredaily.com/photos/2024/04/30/2024043016323768783_m.jpg)
![[중견차 3사3색 돌파구] ①한국GM, 쉐보레·캐딜락·GMC ‘멀티 브랜드 전략’ 가속](https://www.ceoscoredaily.com/photos/2024/04/29/2024042917410481170_m.jpg)
![[현장을 가다] 아모레뷰티파크에서 탄생 100주년 서성환 선대회장의 '동백나무 정신'을 만나다](https://www.ceoscoredaily.com/photos/2024/03/22/2024032213414139276_m.jpg)

![[그래픽] 신한금융 디지털 재무적 기여도](https://www.ceoscoredaily.com/photos/2024/05/02/2024050210000591039_m.jpg)
























































































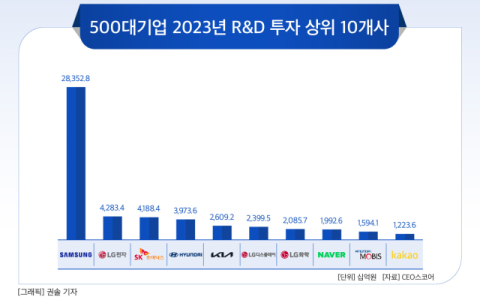
![[24-03호]_500대기업 R&D 투자 현황](https://www.ceoscoredaily.com/photos/2024/04/17/2024041718513086340_m.jpg)

![[이달의 주식부호] 홍라희 여사 2위 탈환…곽동신 한미반도체 부회장 6위로 2계단↑](https://www.ceoscoredaily.com/photos/2024/04/03/2024040314314813956_m.jpg)



![[그래픽] 그레이트 컴퍼니 우수기업 리스트](https://www.ceoscoredaily.com/photos/2023/08/24/2023082410452781615_m.jpg)



댓글
[ 300자 이내 / 현재: 0자 ]
현재 총 0개의 댓글이 있습니다.