회사 측, “해외 진출 목적, 내년 하반기 출시 목표”
앞서 호주에서 임상 2상 종료 후 국내 허가 위해 임상 3상도 진행
메디톡스 자회사 메디톡스코리아(대표 주희석·오경석)가 개발하고 있는 보툴리눔톡신 제제의 해외 진출을 위해 국내에서 임상시험을 추가로 진행하기로 했다.
27일 식품의약품안전처에 따르면 메디톡스코리아는 최근 보툴리눔톡신 제제 MBA-P01의 임상 2상 시험계획을 승인받았다.
이번 임상은 미국 등 선진국 시장 진출에 활용할 추가 임상 자료를 위해 진행한다는 게 회사 측 설명이다.
메디톡스코리아 관계자는 “호주에서 임상 2상을 진행했지만 추가로 국내 임상 2상을 하는 이유는 미국 등 선진국 시장에 진출할 때 국내 임상이 도움이 되기 때문”이라고 설명했다.
이어 “MBA-P01은 내년 하반기 출시가 목표”라고 덧붙였다.
앞서 메디톡스는 호주에서 임상 2상을 진행했으며, 이를 토대로 지난 6월 식약처로부터 임상 3상 시험계획서를 승인받은 바 있다. 국내 임상 3상의 경우 국내 허가 목적으로 진행하고 있다.
회사 측은 MBA-P01은 동결 건조 제형의 기존 보툴리눔톡신 제제와 달리 새로운 제조공정을 적용한 원액을 사용하고 최신 기술을 적용, 생산 수율과 품질을 향상시켰다고 설명했다. 또 제조과정 중 보툴리눔 균주 배양 단계에서 사용되는 동물 유래 물질 단백질 대신 비동물성 원료 배지를 사용한 것이 특징이다.
메디톡스는 기존에 국내에서 △메디톡신 △이노톡스 △코어톡스 등 3가지 보툴리눔톡신 제제의 허가를 획득했으나, 현재 전 제품에 식품의약품안전처가 품목허가 취소 처분을 내린 상태다. 메디톡스가 품목허가 취소 처분 등에 대한 집행정지를 신청했고, 받아들여 졌지만 전과 같은 매출 회복엔 시간이 걸리고 있다.
메디톡스와 보툴리눔톡신 판매 법인인 메디톡스코리아 입장에서는 신규 보툴리눔톡신 제제의 빠른 개발이 필요하다. 이 회사는 기존에 확보한 영업인력이 있고, 전국 병의원 대상으로 판매망도 구축한 경험이 있기 때문에 신규 보툴리눔톡신 제제의 시장 진입은 무리가 없을 것으로 전망된다.
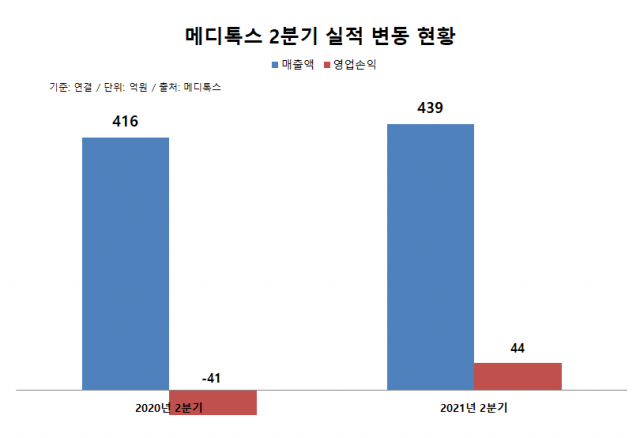
메디톡스는 올해 2분기 연결 기준 매출액 439억원, 영업이익 44억원을 기록했다. 매출액은 지난해 동기 대비 5.5% 증가했으며 영업손익은 흑자전환했다. 영업손익은 2019년3분기 이후 7분기 만의 흑자전환이다.
[CEO스코어데일리 / 김윤선 기자 / yskk@ceoscore.co.kr]



![[현장을 가다] ‘자동차 메카’에서 ‘전기차 허브’로…현대차 울산공장 가보니](https://www.ceoscoredaily.com/photos/2024/03/22/2024032216190656760_m.jpg)
![[4·10 총선] 野, 금융공약 ‘생계비계좌’ 도입…비트코인 현물 ETF 허용 추진](https://www.ceoscoredaily.com/photos/2024/04/05/2024040517040346372_m.jpg)
![[4·10 총선] 與, 금융분야 ‘금투세 폐지’ 드라이브…중도상환수수료 개선 공약](https://www.ceoscoredaily.com/photos/2024/04/04/2024040417544322677_m.jpg)

![[그래픽] SKT의 글로벌향 AI 사업 전개 현황](https://www.ceoscoredaily.com/photos/2024/04/24/2024042409241826407_m.jpg)























































































![[24-03호]_500대기업 R&D 투자 현황](https://www.ceoscoredaily.com/photos/2024/04/17/2024041718513086340_m.jpg)

![[이달의 주식부호] 홍라희 여사 2위 탈환…곽동신 한미반도체 부회장 6위로 2계단↑](https://www.ceoscoredaily.com/photos/2024/04/03/2024040314314813956_m.jpg)



![[그래픽] 그레이트 컴퍼니 우수기업 리스트](https://www.ceoscoredaily.com/photos/2023/08/24/2023082410452781615_m.jpg)



댓글
[ 300자 이내 / 현재: 0자 ]
현재 총 0개의 댓글이 있습니다.