비강 채취 방식에 비해 채취 난이도 낮고 고통도 없어
체외진단 전문기업 GC녹십자엠에스(대표 안은억)가 타액으로 신종 코로나바이러스 감염증(코로나19) 감염 여부를 판단할 수 있는 검사시약을 출시할 예정이다.
23일 식품의약품안전처에 따르면 GC녹십자엠에스가 최근 타액 기반 코로나19 검사시약인 ‘GENEDIA W COVID-19 Ag (SALIVA)’를 수출용으로 허가받았다.
이 검사시약은 호흡기 감염 증상이 있는 환자의 타액 검체에서 코로나19 항원을 면역크로마토그래피법(ICA)으로 정성하는 체외진단의료기기다.
GC녹십자엠에스가 타액으로 코로나19 감염 여부를 판단할 수 있는 검사시약을 허가받은 것은 이번이 처음이다.
기존엔 주로 코 안쪽 깊숙이 면봉을 밀어 넣어 검체를 채취하는 비인두도말법을 사용해왔다. 전 세계적인 표준검사법은 비인두도말 PCR(유전자증폭) 검사다.
비인두도말법은 검체 체취가 어려워 숙련된 의료인이 아닌 자가 하기 어렵다는 문제가 있다. 고통이 느껴질 수 있기 때문에 자가 채취도 힘들다.
대안으로 나온 것이 타액검사법이다. 미국 식품의약국(FDA)는 지난해 4월 타액 검사법을 긴급사용승인했다. 국내에서도 지난해 말 타액검사법 보급을 추진했다. 다만, 아직도 국내에서 일반적으로 사용되고 있는 것은 비인두도말법이다.
타액검사법은 비인두도말법에 비해 다소 정확도가 떨어지는 것으로 알려졌다. 하지만 비의료인이라도 체취가 쉽고 체취 시 고통이 없다는 게 장점이다.
GC녹십자엠에스가 이번에 허가받은 것은 항원 검사로, 빠르다는 장점이 있다.
아직 전 세계적으로 코로나19 환자가 꾸준히 발생하고 있다. 특히, 하루 1만명이 넘는 확진자가 나오는 국가들은 빠른 진단법에 대한 수요가 높은 것으로 알려졌다.
GC녹십자엠에스는 빠른 진단에 대한 수요가 높은 해외 국가를 중심으로 수출을 타진할 것으로 전망된다. 수출이 아닌 국내 허가 계획은 정해지지 않은 상태다.
GC녹십자엠에스 측은 “이번에 허가받은 제품은 계약 상대방이 정해지지 않아 구체적인 수출 계획은 잡혀있지 않다”면서 “국내 허가 획득 여부도 정해진 것이 없다”고 설명했다.
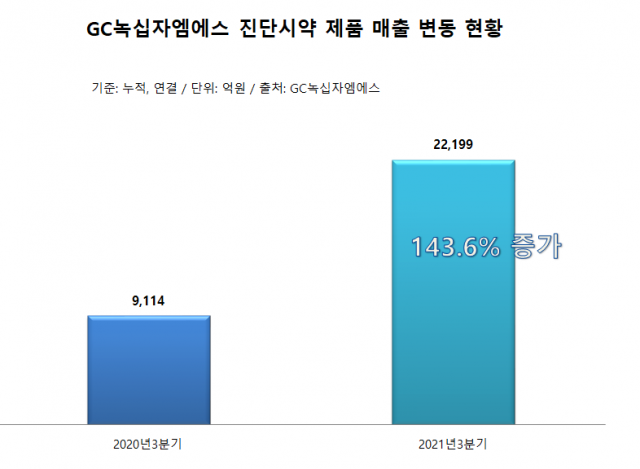
올해 3분기 누적 GC녹십자엠에스의 전체 매출에서 진단시약제품(면역검사·분자검사 등) 매출이 차지하는 비중은 24.76%(약 222억원)에 달했다. 코로나19 진단키트 수요가 늘면서 3분기 진단시약 제품 매출이 지난해 동기 대비 143.6% 증가했다.
GC녹십자엠에스는 지난해 5월 코로나19 진단시약 수출용 허가로 관련 시장에 진출한 바 있다.
[CEO스코어데일리 / 김윤선 기자 / yskk@ceoscore.co.kr]



![[4·10 총선] 野, 금융공약 ‘생계비계좌’ 도입…비트코인 현물 ETF 허용 추진](https://www.ceoscoredaily.com/photos/2024/04/05/2024040517040346372_m.jpg)
![[4·10 총선] 與, 금융분야 ‘금투세 폐지’ 드라이브…중도상환수수료 개선 공약](https://www.ceoscoredaily.com/photos/2024/04/04/2024040417544322677_m.jpg)
![[2024 전망] 유통업계, ‘불황형 소비’ 속 기회 모색…“업체간 생존경쟁 치열할 듯”](https://www.ceoscoredaily.com/photos/2024/01/04/2024010417183989377_m.jpg)

![[그래픽] 현대그린푸드 실적 추이](https://www.ceoscoredaily.com/photos/2024/04/18/2024041809281806246_m.jpg)
























































































![[24-03호]_500대기업 R&D 투자 현황](https://www.ceoscoredaily.com/photos/2024/04/17/2024041718513086340_m.jpg)

![[이달의 주식부호] 홍라희 여사 2위 탈환…곽동신 한미반도체 부회장 6위로 2계단↑](https://www.ceoscoredaily.com/photos/2024/04/03/2024040314314813956_m.jpg)



![[그래픽] 그레이트 컴퍼니 우수기업 리스트](https://www.ceoscoredaily.com/photos/2023/08/24/2023082410452781615_m.jpg)



댓글
[ 300자 이내 / 현재: 0자 ]
현재 총 0개의 댓글이 있습니다.